Лекция № 11. Альдегиды и кетоны
Лекция № 11
АЛЬДЕГИДЫ И КЕТОНЫ
План
1. Методы получения.
2. Химические свойства.
2.1. Реакции нуклеофильного
присоединения.
2.2. Реакции по a -углеродному атому.
2.3. Реакции окисления и восстановления.
Лекция № 11
АЛЬДЕГИДЫ И КЕТОНЫ
План
1. Методы получения.
2. Химические свойства.
2.1. Реакции нуклеофильного
присоединения.
2.2. Реакции по a -углеродному атому.
2.3. Реакции окисления и восстановления.
Альдегиды и кетоны содержат карбонильную группу
С=О. Общая формула:
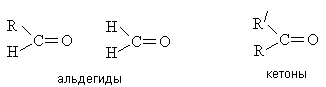
1. Методы получения.
- Окисление и дегидрирование спиртов (см. лек. № 10 ):
.gif)
- Гидратация алкинов (см. лек. № 7 ):
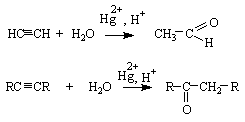
- Ацилирование аренов (см. лек. № 8 ):
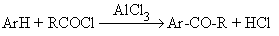
- Восстановление хлорангидридов карбоновых
кислот по Розенмунду:
.gif)
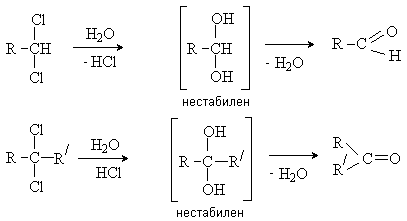
- Гидролиз гем-дигалогенидов:
2. Химические
свойства.
Альдегиды и кетоны – один из наиболее реакционноспособных классов
органических соединений. Их химические свойства определяются присутствием
карбонильной группы. Вследствие большого различия в электроотрицательностях
углерода и кислорода и высокой поляризуемости p -связи связь С=О обладает значительной полярностью
(mС=О=2,5-2,8 D). Атом углерода карбонильной
группы несет эффективный положительный заряд и является объектом для атаки
нуклеофилов. Основной тип реакций альдегидов и кетонов – реакции
нуклеофильного присоединения AdN. Кроме того, карбонильная группа оказывает влияние на
реакционную способность связи С-Н в a -положении, повышая ее кислотность.
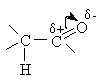
Таким образом, молекулы альдегидов и кетонов
содержат два основных реакционных центра – связь С=О и связь С-Н в a -положении:
2.1. Реакции нуклеофильного
присоединения.
Альдегиды и кетоны легко присоединяют нуклеофильные реагенты по С=О связи.
Процесс начинается с атаки нуклеофила по карбонильному атому углерода. Затем
образующийся на первой стадии тетраэдрический интермедиат присоединяет протон и
дает продукт присоединения:
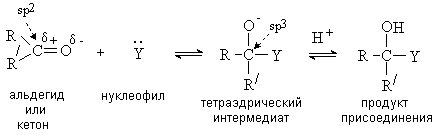
Активность карбонильных соединений в
AdN–реакциях зависит от величины
эффективного положительного заряда на карбонильном атоме углерода и объема
заместителей у карбонильной группы. Электронодонорные и объемистые заместители
затрудняют реакцию, электроноакцепторные заместители повышают реакционную
способность карбонильного соединения. Поэтому альдегиды в
AdN–реакциях активнее, чем
кетоны.
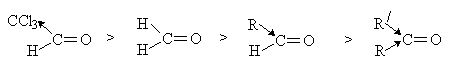
Активность карбонильных соединений повышается в
присутствии кислотных катализаторов, которые увеличивают положительный заряд на
карбонильном атоме углерода:
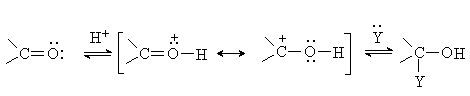
Альдегиды и кетоны присоединяют воду, спирты,
тиолы, синильную кислоту, гидросульфит натрия, соединения типа
NH2X. Все реакции присоединения
идут быстро, в мягких условиях, однако образующиеся продукты, как правило,
термодинамически не устойчивы. Поэтому реакции протекают обратимо, и содержание
продуктов присоединения в равновесной смеси может быть низким.
Присоединение воды.
Альдегиды и кетоны присоединяют воду с
образованием гидратов. Реакция протекает обратимо. Образующиеся гидраты
термодинамически не стабильны. Равновесие смещено в сторону продуктов
присоединения только в случае активных карбонильных соединений.
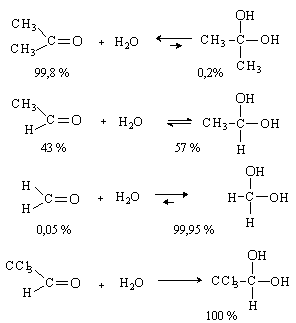
Продукт гидратации трихлоруксусного альдегида
хлоральгидрат – устойчивое кристаллическое соединение, которое используется в
медицине как успокаивающее и снотворное средство.
Присоединение спиртов и
тиолов.
Альдегиды присоединяют спирты с образованием полуацеталей. При избытке спирта и в присутствии кислотного катализатора
реакция идет дальше – до образования ацеталей
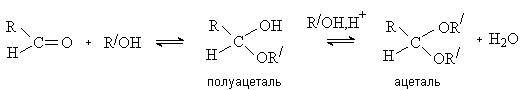
Реакция образования полуацеталя протекает как
нуклеофильное присоединение и ускоряется в присутствии кислот или
оснований.
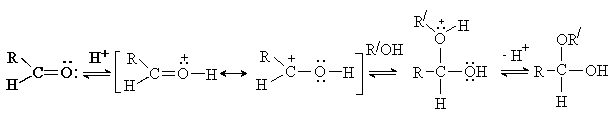
Процесс образования ацеталя идет как
нуклеофильное замещение ОН группы в полуацетале и возможен только в условиях
кислотного катализа, когда группа ОН превращается в хорошую уходящую группу
(H2O).
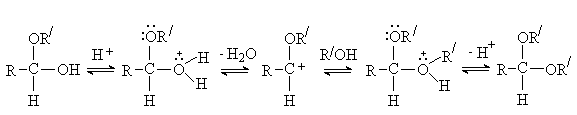
Образование ацеталей – обратимый процесс. В
кислой среде полуацетали и ацетали легко гидролизуются. В щелочной среде
гидролиз не идет. Реакции образования и гидролиза ацеталей играют важную роль в
химии углеводов.
Кетоны в аналогичных условиях кеталей не
дают.
Тиолы как более сильные нуклеофилы, чем спирты,
образуют продукты присоединения и с альдегидами, и с кетонами.
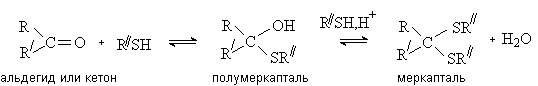
Присоединение синильной
кислоты
Синильная кислота присоединяется к карбонильным соединением в условиях
основного катализа с образованием циангидринов.
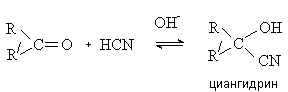
Реакция имеет препаративное значение и
используется в синтезе a -гидрокси- и a -аминокислот (см. лек. № 14). Плоды некоторых растений
(например, горький миндаль) содержат циангидрины. Выделяющаяся при их
расщеплении синильная кислота оказывает отравляющее действие.
Присоединение бисульфита
натрия.
Альдегиды и метилкетоны присоединяют бисульфит натрия NaHSO3 c образованием бисульфитных производных.
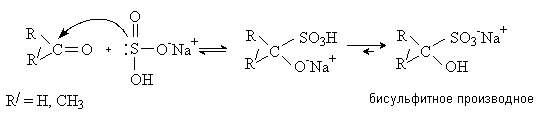
Бисульфитные производные карбонильных соединений
– кристаллические вещества, не растворимые в избытке раствора бисульфита натрия.
Реакция используется выделения карбонильных соединений из смесей. Карбонильное
соединение может быть легко регенерировано обработкой бисульфитного производного
кислотой или щелочью.
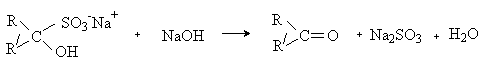
Взаимодействие с соединениями общей
формулы NH2X.
Реакции протекают по общей схеме как процесс
присоединения-отщепления. Образующийся на первой стадии продукт присоединения не
устойчив и легко отщепляет воду.
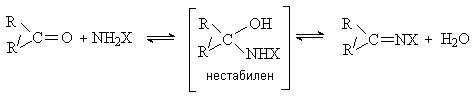
По приведенной схеме с карбонильными
соединениями реагируют аммиак, первичные амины, гидразин, замещенные гидразины,
гидроксиламин.
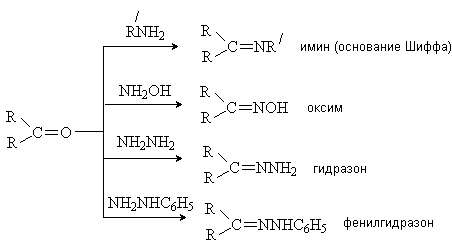
Образующиеся производные представляют собой
кристаллические вещества, которые используют для выделения и идентификации
карбонильных соединений.
Имины (основания Шиффа) являются промежуточными
продуктами во многих ферментативных процессах (трансаминирование под действием
кофермента пиридоксальфосфата; восстановительное аминирование кетокислот при
участии кофермента НАД Н). При каталитическом гидрировании иминов образуются
амины. Процесс используется для синтеза аминов из альдегидов и кетонов и
называется восстановительным аминированием.
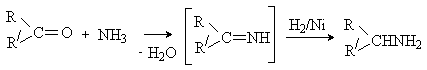
Восстановительное аминирование протекает in vivo
в ходе синтеза аминокислот (см. лек. № 16)
2.2. Реакции по a -углеродному атому.
Кето-енольная таутомерия.
Водород в a -положении к карбонильной группе обладает кислотными
свойствами, так как образующийся при его отщеплении анион стабилизируется за
счет резонанса.
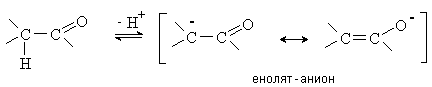
Результатом протонной подвижности атома водорода
в a -положении
является способность карбонильных соединений к образованию енольных форм за счет
миграции протона из a -положения к атому кислорода карбонильной группы.
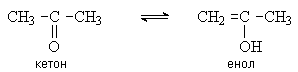
Кетон и енол являются таутомерами.
Таутомеры – это изомеры, способные быстро и обратимо превращаться друг в друга
за счет миграции какой-либо группы (в данном случае – протона). Равновесие между
кетоном и енолом называют кето-енольной таутомерией.
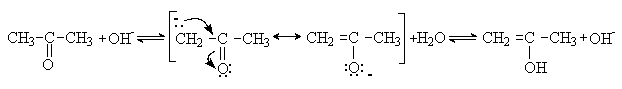
Процесс енолизации катализируется кислотами и
основаниями. Енолизация под действием основания может быть представлена
следующей схемой:
Большинство карбонильных соединений существуют
преимущественно в кетонной форме. Содержание енольной формы возрастает с
увеличением кислотности карбонильного соединения, а также в случае
дополнительной стабилизации енольной формы за счет водородной связи или за счет
сопряжения.
Таблица 8. Содержание енольных форм и
кислотность карбонильных соединений
Соединение |
рКа |
Содержание енола, % |
Ацетон CH3COCH3
|
20 |
6 10-7 |
Ацетоуксусный эфир CH3COCH2COOC2H5
|
11 |
8,0 |
Ацетилацетон CH3COCH2COCH3
|
9 |
76,4 |
Например, в 1,3-дикарбонильных соединениях
подвижность протонов метиленовой группы резко увеличивается за счет
электроноакцепторного влияния двух карбонильных групп. Кроме того, енольная
форма стабилизируется за счет наличия в ней системы сопряженных p -связей и внутримолекулярной
водородной связи.
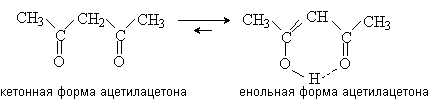
Если соединение в енольной форме представляет
собой сопряженную систему с высокой энергией стабилизации, то енольная форма
преобладает. Например, фенол существует только в енольной форме.
Енолизация и образование енолят-анионов являются
первыми стадиями реакций карбонильных соединений, протекающих по a -углеродному атому. Важнейшими
из них являются галогенирование и альдольно-кротоновая
конденсация.
Галогенирование.
Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl2,
Br2, I2) с образованием
исключительно a -галогенпроизводных.
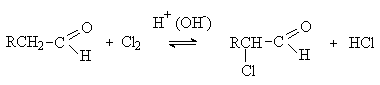
Реакция катализируется кислотами или
основаниями. Скорость реакции не зависит от концентрации и природы галогена.
Процесс протекает через образование енольной формы (медленная стадия), которая
затем реагирует с галогеном (быстрая стадия). Таким образом, галоген не
участвует в скорость—определяющей стадии
процесса.
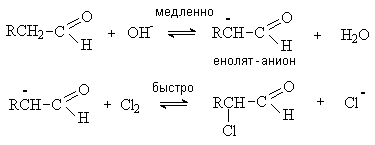
Если карбонильное соединение содержит несколько a -водородных
атомов, то замещение каждого последующего происходит быстрее, чем предыдущего,
вследствие увеличения их кислотности под действием электроноакцепторного влияния
галогена. В щелочной среде ацетальдегид и метилкетоны дают
тригалогенпроизводные, которые затем расщеплятся под действием избытка щелочи с
образованием тригалогенметанов (галоформная реакция).
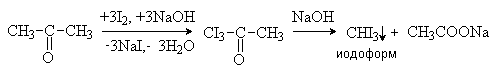
Расщепление трииодацетона протекает как реакция
нуклеофильного замещения. группы CI3— гидроксид-анионом, подобно SN-реакциям в карбоксильной группе (см. лек. №12).
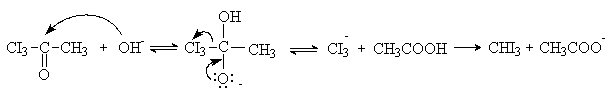
Иодоформ выпадает из реакционной смеси в виде
бледно-желтого кристаллического осадка с характерным запахом. Иодоформную
реакцию используют в аналитических целях для обнаружения соединений типа
СH3-CO-R, в том числе в
клинических лабораториях для диагностики сахарного диабета.
Реакции конденсации.
В присутствии каталитических количеств кислот
или щелочей карбонильные соединения, содержащие a -водородные атомы,
претерпевают конденсацию с образованием b -гидроксикарбонильных соединений.
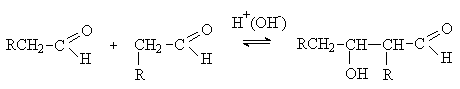
В образовании связи С-С участвуют карбонильный
атом углерода одной молекулы (карбонильной компоненты) и a -углеродный атом другой
молекулы (метиленовой компоненты). Эта реакция носит название альдольной конденсации (по названию продукта конденсации ацетальдегида –
альдоля).
При нагревании реакционной смеси продукт легко
дегидратируется с образованием a ,b -непредельного карбонильного
соединения.
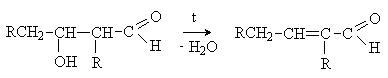
Такой тип конденсации носит название кротоновой (по названию продукта конденсации ацетальдегида – кротонового
альдегида).
Рассмотрим механизм альдольной конденсации в
щелочной среде. На первой стадии гидроксид-анион отрывает протон из a -положения карбонильного
соединения с образованием енолят-аниона. Затем енолят анион как нуклеофил
атакует карбонильный атом углерода другой молекулы карбонильного соединения.
Образующийся тетраэдрический интермедиат (алкоксид-анион) является сильным
основанием и отрывает далее протон от молекулы воды.
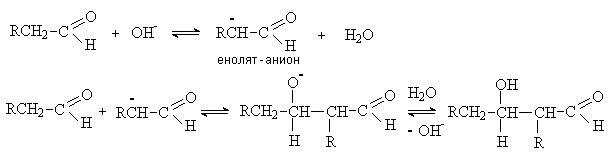
При альдольной конденсации двух различных
карбонильных соединений (перекрестная альдольная конденсация) возможно
образование 4-х разных продуктов. Однако этого можно избежать, если одно из
карбонильных соединений не содержит a -водородных атомов (например, ароматические альдегиды
или формальдегид) и не может выступать в качестве метиленовой компоненты.
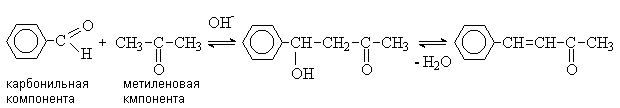
В качестве метиленовой компоненты в реакциях
конденсации могут выступать не только карбонильные соединения, но и другие
С-Н-кислоты. Реакции конденсации имеют препаративное значение, так как позволяют
наращивать цепь углеродных атомов. По типу альдольной конденсации и
ретроальдольного распада (обратный процесс) протекают многие биохимические
процессы: гликолиз, синтез лимонной кислоты в цикле Кребса, синтез нейраминовой
кислоты.
2.3. Реакции окисления и
восстановления
Восстановление
Карбонильные соединения восстанавливаются до
спиртов в результате каталитического гидрирования или под действием
восстановителей, которые являются донорами гидрид-анионов.
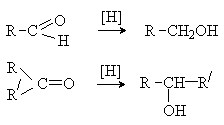
[H]: H2/кат., кат. – Ni, Pt,
Pd;
LiAlH4; NaBH4 .
Восстановление карбонильных соединений
комплексными гидридами металлов включает нуклеофильную атаку карбонильной группы
гидрид-анионом. При последующем гидролизе образуется спирт.
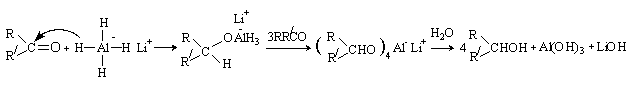
Аналогично происходит восстановление
карбонильной группы in vivo под действием кофермента НАД Н, который является
донором гидрид-иона (см. лек. №19).
Окисление
Альдегиды окисляются очень легко практически
любыми окислителями, даже такими слабыми, как кислород воздуха и соединения
серебра (I) и меди (II).
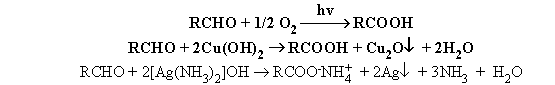
Две последние реакции используются как
качественные на альдегидную группу.
В присутствии щелочей альдегиды, не содержащие a-водородных атомов
диспропорционируют с образованием спирта и кислоты (реакция Канницаро).
2HCHO + NaOH ® HCOONa + CH3OH
Это является причиной того, что водный раствор
формальдегида (формалин) при длительном хранении приобретает кислую
реакцию.
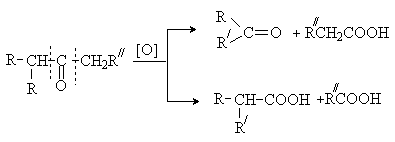
Кетоны устойчивы к действию окислителей в
нейтральной среде. В кислой и щелочной средах под действием сильных
окислителей (KMnO4) они
окисляются с разрывом связи С-С. Расщепление углеродного скелета происходит по
двойной углерод-углеродной связи енольных форм карбонильного соединения, подобно
окислению двойных связей в алкенах. При этом образуется смесь продуктов,
содержащая карбоновые кислоты или карбоновые кислоты и кетоны.
Где можно это скачать?
Не могу скачать.