Лекция № 10. Гидроксилпроизводные углеводородов
Лекция № 10
ГИДРОКСИЛПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
План
- Методы получения спиртов.
- Химические свойства спиртов.
- Многоатомные спирты.
- Фенолы. Методы получения.
- Фенолы. Химические свойства.
- Простые эфиры.
Лекция № 10
ГИДРОКСИЛПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
План
- Методы получения спиртов.
- Химические свойства спиртов.
- Многоатомные спирты.
- Фенолы. Методы получения.
- Фенолы. Химические свойства.
- Простые эфиры.
Гидроксилпроизводные содержат в молекуле одну или
несколько групп ОН. Гидроксилпроизводные, содержащие связь ![]() , называют спиртами. Соединения,
, называют спиртами. Соединения,
содержащие группу ОН при двойной связи, называют енолами, в ароматическом
кольце – фенолами.
1. Методы получения
спиртов.
- Гидролиз галогенпроизводных:
- Гидратация алкенов:
- Восстановление карбонильных
соединений:
[H]: H2/кат., кат. – Ni, Pt,
Pd;
LiAlH4; NaBH4 .
2. Химические свойства
спиртов.
Реакции спиртов определяются присутствием группы ОН и протекают по следующим
основным направлениям.
- Замещение водорода ОН группы под действием оснований (кислотные
свойства). - Взаимодействие с электрофильными реагентами по атому кислорода с
неподеленной парой электронов (основные и нуклеофильные свойства). - Взаимодействие с нуклеофильными реагентами
по a -углеродному атому, несущему частичный положительный заряд (реакции
нуклеофильного замещения ОН группы). - Дегидратация (участвуют связь С-Н в b -положении и связь
С-О). - Окисление (участвуют связь С-Н в a -положении и
связь О-Н).
Кислотные свойства
Спирты взаимодействуют с активными металлами (Na, K, Mg, Al и др.) с
образованием алкоголятов:
C2H5OH + Na ® С2H5O—Na+ + 0,5
H2
натрия
3(СH3)2CHOH + Al ® ((CH3)2CHO)3Al + 1,5 H2
изопропилат
алюминия
действии на спирты сильных оснований:
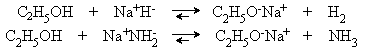
При
взаимодействии спиртов со щелочами равновесие сдвинуто в сторону гидролиза
алкоголятов, так как спирты являются более слабыми кислотами, чем вода:
Кислотность спиртов уменьшается в ряду:
CH3OH |
первичный |
вторичный |
третичный |
|
pKa |
15,2 |
~16 |
~16,5 |
~17 |
Основные и нуклеофильные свойства
спиртов
Спирты взаимодействуют с протонными кислотами и кислотами Льюиса с
образованием оксониевых соединений:
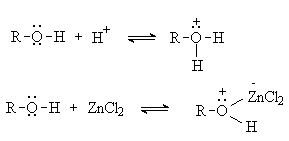
Образование оксониевых соединений играет важную роль в
процессах замещения гидроксильной группы.
Нуклеофильные свойства спиртов проявляются в их
реакциях с карбоновыми и неорганическими кислотами и их производными с
образованием сложных эфиров:
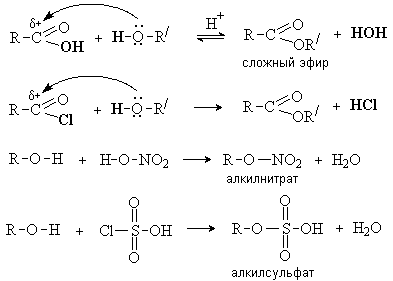
Спирты – слабые нуклеофилы. Для увеличения
нуклеофильности их превращают в алкоголяты, которые способны взаимодействовать с
галогенпроизводными с образованием простых эфиров:
R-Hal + R/O—Na+ ® R-OR/ + NaHal
Однако алкоголят-ионы не только сильные нуклеофилы, но и
сильные основания. Поэтому их взаимодействие с алкилгалогенидами может привести
как к замещению, так и к элиминированию в зависимости от температуры и структуры
алкилгалогенида и алкоголята. Например, для получения метилизопропилового эфира
необходимо использовать метилиодид и
изопропилат-анион, а не изопропилиодид и метилат-анион, так как в последнем
случае будет доминировать реакция отщепления:
Реакции нуклеофильного замещения ОН
группы
Протекание реакции по схеме:
![]()
невозможно, поскольку
гидроксид-анион – это сильное основание и плохая уходящая группа. Для проведения
SN-реакций в спиртах необходимо
предварительно модифицировать ОН группу, превратив ее в хорошую уходящую группу.
Для этого спирты переводят в оксониевые соединения или эфиры неорганических
кислот:
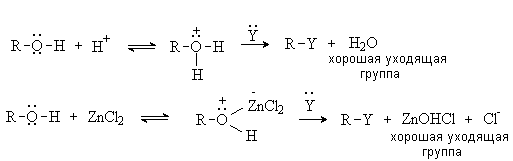
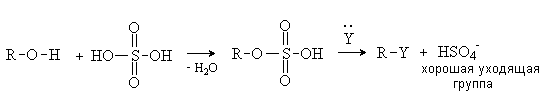
В биохимических процессах замещение ОН группы
протекает через стадию превращения спиртов в эфиры фосфорной, дифосфорной и
трифосфорной кислот, анионы которых являются чрезвычайно легко уходящими
группами:
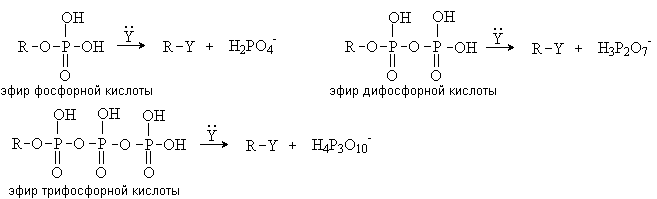
Замещение ОН группы на галоген
Спирты взаимодействуют с галогеноводородами и галогенидами фосфора и серы с
образованием галогенпроизводных.
1. Действие галогеноводородов.
-
R-OH + HHal ® R-Hal + H2O
Реакция протекает через стадию протонирования ОН группы с
последующим нуклеофильным замещением по механизму SN1 или SN2.
![]()
Первичные
спирты реагируют по механизму SN2. Реакция идет медленно, так как в протонных
растворителях (вода, спирты) галогенид-ионы – слабые нуклеофилы. Вторичные и
третичные спирты реагируют по механизму SN1. Таким образом, реакционная способность спиртов
возрастает в ряду:
первичный < вторичный < третичный
Реакционная
способность галогеноводородов увеличивается в ряду:
HCl < HBr < HI
параллельно с возрастанием силы кислот и нуклеофильности
галогенид-анионов. Однако HI не может быть использована, так как легко
восстанавливает спирты до углеводородов. HBr реагирует с первичными, вторичными
и третичными спиртами. HCl действует только на третичные спирты.
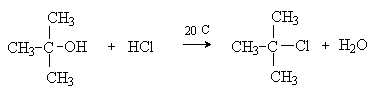
Для вторичных и первичных спиртов требуется
присутствие катализатора – кислоты Льюиса.
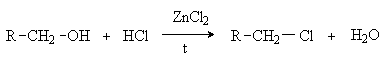
2. Действие галогенидов фосфора и
серы.
Замещение ОН группы
действием PBr3, PCl5, POCl3,
PI3, SOCl2 основано на
предварительном превращении спирта в эфиры кислот фосфора и серы, которые затем
атакуются галогенид-анионом.
ROH + SOCl2 ® RCl + SO2 +
HCl
ROH + PCl5 ® RCl + POCl3 + HCl
3ROH + PBr3 ® 3RBr +
H3PO3
Образование простых эфиров
При нагревании спиртов в присутствии серной кислоты происходит замещение ОН
группы на группу OR и образуются простые эфиры.
![]()
Реакция
протекает через стадию протонирования спирта с последующим нуклеофильным
замещением, в котором одна молекула спирта (протонированная) выполняет роль
субстрата, а вторая – нуклеофила.
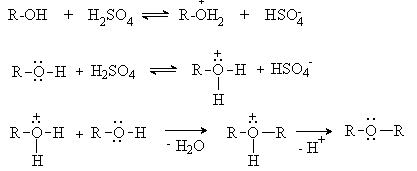
Дегидратация спиртов
При нагревании в присутствии кислотных катализаторов спирты отщепляют воду с
образованием алкенов.
Реакции дегидратации (элиминирования) протекают
параллельно с образованием простых эфиров (замещением). Дегидратации
способствует высокая температура. Например:
Склонность спиртов к дегидратации возрастает в
ряду: первичный < вторичный < третичный
При дегидратации спиртов соблюдается правило
Зайцева.
Окисление спиртов
Под окислением в органической химии понимают процессы, приводящие к обеднению
субстрата водородом или к обогащению его кислородом. Окисление спиртов
осуществляют при помощи двух основных приемов – дегидрирования и действия
окислителей.
Дегидрирование
Первичные и вторичные спирты отщепляют водород при
нагревании в присутствии медно-серебряного катализатора с образованием
карбонильных соединений.
Третичные спирты в таких условиях не реагируют,
а в более жестких – разрушаются.
Действие окислителей
![]()
Для окисления спиртов используют
KMnO4, Na2Cr2O7,
CrO3.
Первичные спирты окисляются до альдегидов,
которые далее легко окисляются до карбоновых кислот.
Реакцию можно остановить на стадии альдегида, если
использовать кислый раствор дихромата натрия и отгонять образующийся альдегид из
реакционной смеси:
Вторичные спирты окисляются до кетонов под
действием KMnO4 или
Na2Cr2O7.
Окисление третичных спиртов протекает в жестких
условиях и сопровождается деструкцией углеродного скелета.
3. Многоатомные спирты.
Атомность спиртов определяется количеством
гидроксильных групп. Двухатомные спирты содержат две гидроксильные группы и
носят общее название диолы или гликоли. Трехатомные спирты
называют триолами или глицеринами. Простейшие и наиболее важные
представители диолов и триолов – этиленгликоль и глицерин.
Этиленгликоль (этандиол-1,2).
Этиленгликоль получают из этилена по следующим
схемам.
Химические свойства этиленгликоля аналогичны
свойствам одноатомных спиртов. Однако есть ряд специфических свойств,
обусловленных присутствием двух гидроксильных групп.
Этиленгликоль является более сильной кислотой,
чем одноатомные спирты (рКа=15,1) и образует в водных растворах
комплексные алкоголяты с ионами тяжелых металлов.
Появляющееся при этом ярко-синее окрашивание
позволяет использовать реакцию как качественную на диольный фрагмент.
При дегидратации этиленгликоля в зависимости от
условий реакции образуются разные продукты. При нагревании в присутствии серной
кислоты происходит межмолекулярная дегидратация с образованием циклического
простого эфира – диоксана. Нагревание с хлоридом цинка дает продукт
внутримолекулярной дегидратации – ацетальдегид.
Этиленгликоль легко окисляется. В зависимости от
природы окислителя могут образоваться гликолевый альдегид, глиоксаль,
глиоксиловая кислота, щавелевая кислота.
Этиленгликоль используется для приготовления
антифризов; для получения растворителей (простые эфиры этиленгликоля, диоксан) и
полимеров (полиэфиров).
Глицерин (1,2,3-
пропантриол).
Глицерин получают гидролизом жиров (см. лек.
№18), но в основном синтетическим путем из пропилена.
Глицерин дает все реакции, известные для
спиртов. Наличие трех гидроксильных групп обуславливает некоторые специфические
свойства.
Глицерин является более сильной кислотой, чем
одноатомные спирты (рКа=14) и, подобно этиленгликолю, образует
хелатные комплексы с ионами металлов.
При дегидратации глицерина образуется
ненасыщенный альдегид акролеин.
Мягкое окисление глицерина дает смесь
глицеринового альдегида и дигидроксиацетона.
Важное значение имеют сложные эфиры глицерина.
При действии на глицерин азотной кислоты в присутствии серной кислоты образуется
тринитрат глицерина (нитроглицерин).
Нитроглицерин используется в производстве
взрывчатых веществ. В малых концентрациях нитроглицерин применяется как
сосудорасширяющее средство.
При действии на глицерин фосфорной кислоты
образуется смесь a — и b -глицерофосфатов.
Глицерофосфаты являются структурными
компонентами фосфолипидов.
Сложные эфиры глицерина и высших жирных кислот –
основная составная часть природных жиров и масел (см. лек. №18).
Примерами многоатомных спиртов, содержащих
четыре, пять и шесть гидроксильных групп, могут служить соответственно эритриты, пентиты и гекситы (см. лек. №17)
4. Фенолы. Методы
получения.
1. Сплавление солей сульфоновых кислот со
щелочами.
2. Щелочной гидролиз хлорбензола.
3. Замещение диазогруппы на гидроксил (см.
также лек. №13).
4. Кумольный метод.
5. Фенолы. Химические
свойства.
Кислотные свойства
Фенолы являются более сильными кислотами, чем спирты, что обусловлено
стабилизацией фенолят аниона за счет делокализации отрицательного заряда по
ароматическому кольцу (см. лек. №4). Для сравнения приведем величины
рКа в воде при 25оС для фенола (10,00), для циклогексанола
(18,00).
Фенолы являются более сильными кислотами, чем
вода, поэтому феноляты, в отличие от алкоголятов, могут быть получены из фенолов
действием водных растворов щелочей.
Карбоновые кислоты и большинство неорганических
кислот, например, угольная, превосходят по кислотности фенол, что используется
для выделения фенола из щелочных растворов.
C6H5O— Na+ + CO2 +
H2O ® C6H5OH +
NaHCO3
Электроноакцепторные
заместители в ароматическом кольце увеличивают, а электронодонорные – уменьшают
кислотность фенолов. Так, 2,4,6-тринитрофенол (пикриновая кислота) по
кислотности (рКа= 0,4) сравним с карбоновыми кислотами.
Нуклеофильные свойства
фенолов
Фенолы являются более слабыми нуклеофилами, чем
спирты, что связано со значительным снижением электронной плотности на атоме
кислорода вследствие сопряжения ОН группы с ароматическим кольцом.
Как слабые нуклеофилы, фенолы очень медленно
реагируют с карбоновыми кислотами. Поэтому сложные эфиры фенолов не могут быть
получены реакцией этерификации. Для их получения необходимы более активные
ацилирующие реагенты – ангидриды и хлорангидриды (см. лек. №12)
ArOH
+ RCOX ® RCOOAr + HX
X=Cl, OCOR
Для увеличения нуклеофильности фенолы переводят в
феноляты, которые легко алкилируются и ацилируются с образованием соответственно
простых и сложных эфиров.
ArO—Na+ + RBr ® ArOR + NaBr
ArO—Na+ + RCOCl ® RCOOAr + NaCl
Реакции электрофильного замещения в
ароматическом кольце фенолов
Гидроксильная группа относится к числу групп, активирующих электрофильное
замещение в ароматическом кольце и направляющих заместитель в орто- и пара-
положения. Активирующее влияние гидроксильной группы настолько сильно, что в
отдельных случаях реакцию трудно остановить на стадии введения только одного
заместителя. Фенолы вступают практически во все типичные реакции электрофильного
замещения как с сильными, так и со слабыми электрофильными агентами.
Фенол легко бромируется бромной водой с образованием трибромфенола.
Нитрование фенолов разбавленной 20-25%-ной
азотной кислотой приводит к получению смеси орто- и пара-нитрофенолов.
Сульфирование фенола серной кислотой дает смесь
орто- и пара-изомеров гидроксибензолсульфоксилоты. При 20оС в
реакционной смеси содержится 49% орто-изомера и 51% пара-изомера, тогда как при
120оС доля пара-изомера возрастает до 96%.
Изменение в соотношении продуктов сульфирования
обусловлено обратимостью реакций сульфирования, когда в равновесии преобладает
термодинамически более стабильный пара-изомер. Сульфирование в орто-положение
протекает с большей скоростью, но орто-гидроксибензолсульфокислота легко
гидролизуется на исходные реагенты в отличие от пара-изомера, для которого
скорость гидролиза мала.
Феноляты в реакциях электрофильного замещения
еще более реакционноспособны, чем фенолы (влияние +I- и +M-эффектов группы
О—). Они взаимодействуют даже с
таким слабым электрофилом, как СО2. При нагревании сухого фенолята натрия с
СО2 при 150-180оС и
давлении 5 атм, образуется натриевая соль салициловой кислоты.
Эфиры салициловой кислоты по гидроксильной и
карбоксильной группам используются как лекарственные средства.
Аспирин и метилсалицилат обладают
анальгетическим, жаропонижающим и противовоспалительным действием. Салол
применяется как дезинфицирующее средство при кишечных заболеваниях, так как не
гидролизуется в кислой среде желудка, а распадается только в кишечнике. Его
используют также в качестве материала защитных оболочек некоторых лекарств,
которые не стабильны в кислой среде желудка.
Окисление фенолов.
Хиноны
Фенолы легко окисляются. При окислении пространственно затрудненных фенолов
образуются устойчивые феноксильные радикалы.
Повышенная устойчивость феноксильных радикалов
связана с возможностью делокализации неспаренного электрона по ароматическому
кольцу. Кроме того, наличие объемистых заместителей в орто-положении
препятствует рекомбинации двух таких радикалов. Стабильность феноксильных
радикалов обуславливает антиокислительные свойства пространственно затрудненных
фенолов. Они выполняют роль ловушек свободных радикалов в процессах пероксидного
окисления. Активный свободный радикал, ведущий цепь окисления, быстро
взаимодействует с таким фенолом, давая устойчивый феноксильный радикал, что
приводит к обрыву цепи.
Роль природных антиоксидантов выполняют витамины группы Е (токоферолы). Антиокислительная функция токоферолов
проявляется в их способности связывать появляющиеся в клетках активные свободные
радикалы в устойчивые феноксильные радикалы, ингибируя, таким образом, процесс
пероксидного окисления липидов.
Повышенную склонность к окислению проявляют
многоатомные фенолы. Окисление фенолов с пара- и орто-расположением
гидроксильных групп приводит соответственно к п- и о-хинонам.
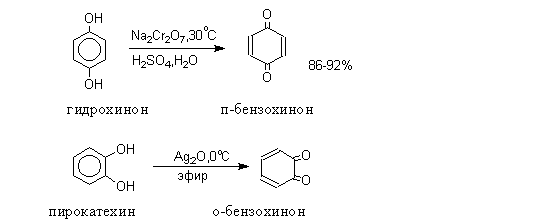
Процесс окисления гидрохинона в 1,4-бензохинон обратим и
дает хорошо воспроизводимый электродный потенциал, величина которого зависит от
рН, что используется в устройстве хингидронного электрода.
Окислительно-восстановительные
свойства системы хинон-гидрохинон играют важную роль в живых организмах (см.
ниже).
1,4-нафтохинон и 9,10-антрахинон могут быть
получены прямым окислением соответствующих углеводородов.
Хиноны широко распространены в
природе и играют роль антибиотиков, пигментов, витаминов, коферментов.
Витамины группы К являются
производными 1,4-нафтохинона и необходимы для обеспечения нормальной
свертываемости крови.
Убихиноны – производные 1,4-бензохинона, содержащие изопреноидную
цепь. Они являются коферментами и играют важную роль переносчика электронов в
дыхательных и фотохимических цепях биологических систем. Принимая электроны от
субстрата, убихиноны могут легко и обратимо восстанавливаться в производные
гидрохинона (см. систему хинон-гидрохинон), которые в свою очередь передают
электроны через цитохромную систему кислороду, обратно окисляясь в убихиноны.
Таким образом убихиноны участвуют в переносе электронов от субстрата к
кислороду.
Двухатомные фенолы – гидрохинон, резорцин, пирокатехин широко
распространены в природе.
Пирокатехин является структурным
элементом многих биологически активных веществ, например, катехоламинов (см.
лек. №13). Монометиловый эфир пирокатехина, гваякол, используется как
лекарственное средство для лечения заболеваний верхних дыхательных путей.
Резорцин применяется как антисептическое средство при лечении кожных
заболеваний.
Гидрохинон является структурным элементом природных соединений, например,
витаминов группы Е. Восстановительная способность гидрохинонового фрагмента
используется в окислительно-восстановительных процессах, сопровождающих дыхание.
Самим гидрохинон служит исходным веществом в синтезе многих лекарственных
средств.
6. Простые эфиры
Простые эфиры можно рассматривать как производные спиртов, в которых атом
водорода гидроксильной группы замещен на углеводородный радикал. По природе
связанных с кислородом углеводородных радикалов различают
диалкиловые эфиры
алкилариловые и диариловые эфиры
циклические простые эфиры
Методы
получения
- Взаимодействие алкоголятов с галогенпроизводными (синтез
Вильямсона).
R-Hal + R/O—Na+ ® R-OR/ + NaHal
- Межмолекулярная дегидратация
спиртов.
Химические
свойства
Простые эфиры обладают низкой
реакционной способностью. Их реакции можно разделить на три группы: реакции по
атому кислорода; реакции по С-Н связи в a -положении; реакции с разрывом связи С-О.
Атом кислорода с неподеленными парами электронов
обуславливает основные свойства простых эфиров. Простые эфиры являются слабыми
основаниями и образуют оксониевые соединения при взаимодействии с сильными
протонными кислотами и кислотами Льюиса.
Простые эфиры вступают в реакции
свободнорадикального хлорирования и окисления. Замещение происходит у a -углеродного
атома.
Направление замещения обусловлено повышенной
стабильностью промежуточно образующегося алкоксиалкильного радикала.
Гидропероксиды – нестабильные взрывоопасные
соединения. Они образуются при длительном хранении простых эфиров на свету.
Поэтому перед использованием простые эфиры необходимо проверять на присутствии
пероксидов.
Реакции с разрывом связи С-О протекают в жестких
условиях в присутствии сильных кислот. Алкоголят анион RO— является сильным основанием и плохой уходящей
группой, поэтому его отщепления возможно только после предварительного
превращения в хорошую уходящую группу путем протонирования.
Эпоксиды Эпоксиды (оксираны, a -оксиды) – циклические
простые эфиры, содержащие атом кислорода в трехчленном цикле.
Получение
- Окисление алкенов.
- Из галогенгидринов путем
внутримолекулярного нуклеофильного замещения.
отличие от других типов простых эфиров эпоксиды –высокореакционноспособные
соединения. Термодинамически неустойчивый трехчленный цикл легко раскрывается
под действием нуклеофильных регентов.
Предполагают, что эпоксиды образуются в качестве
промежуточных продуктов ферментативного окисления кислородом двойных связей
углерод-углерод. Дальнейшие их превращения приводят к введению гидроксильной
группы в природные соединения.