Лекция № 14. Гидрокси и оксокислоты
Лекция № 14
ГИДРОКСИ- И ОКСОКИСЛОТЫ
План
1. Гидроксикислоты.
1.1. Методы получения.
1.2. Химические свойства.
1.3. Биологически важные гидроксикислоты.
2. Оксокислоты.
2.1. Методы получения.
2.2. Химические свойства
Большинство биологически важных органическихсоединений (метаболиты, биорегуляторы, структурные элементы биополимеров,
лекарственные средства) являются гетерофункциональными соединениями. Наиболее
важные из них — гидрокси-, оксо- и аминокислоты.
Лекция № 14
ГИДРОКСИ- И ОКСОКИСЛОТЫ
План
1. Гидроксикислоты.
1.1. Методы получения.
1.2. Химические свойства.
1.3. Биологически важные гидроксикислоты.
2. Оксокислоты.
2.1. Методы получения.
2.2. Химические свойства
Большинство биологически важных органических
соединений (метаболиты, биорегуляторы, структурные элементы биополимеров,
лекарственные средства) являются гетерофункциональными соединениями. Наиболее
важные из них — гидрокси-, оксо- и аминокислоты.
1. Гидроксикислоты
Гидроксикислоты – гетерофункциональные
соединения, содержащие карбоксильную и гидроксильную группы. По взаимному
расположению функциональных групп различают a -,b -, g — и т.д. гидроксикислоты.
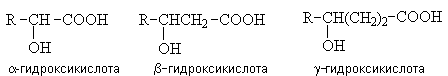
В природе широко распространены
полигидроксикарбоновые кислоты (содержат нескольно гидроксильных групп) и
гидроксиполикарбоновые кислоты (содержат несколько карбоксильных групп).
1.1. Методы
получения.
Общие методы получения.
1) Гидролиз галогензамещенных кислот.
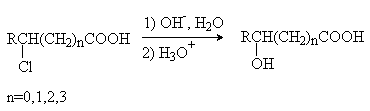
2) Взаимодействие аминокислот с азотистой
кислотой.
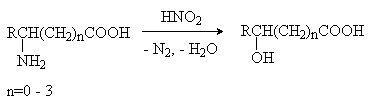
3) Восстановление оксокислот.
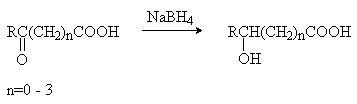
4) Присоединение воды к непредельным
кислотам.
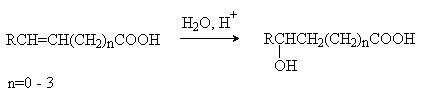
Методы получения a-гидроксикислот.
a -Гидроксикислоты
получают из доступных a -галогензамещенных аминокислот (метод 1), из природных a -аминокислот
(метод 2), восстановлением a -оксокислот (метод 3). Специфический метод получения a -гидроксикислот –
циангидринный синтез.
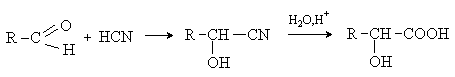
b -Гидроксикислоты
получают восстановлением доступных b -оксокислот (метод 3), присоединением воды (против
правила Марковникова) к a ,b -непредельным кислотам (метод
4). Специфическими методами синтеза b -гидроксикислот являются следующие.
Окисление b -гидроксикарбонильных соединений (продуктов альдольной
конденсации).
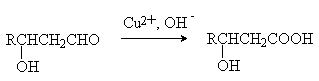
Реакция Реформатского (из карбонильных
соединений и a -галогенэфиров).
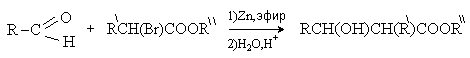
Получение полигидроксиполикарбоновых
кислот.
1) Окисление моносахаридов (см. лек. №16)
2) Окисление непредельных кислот.
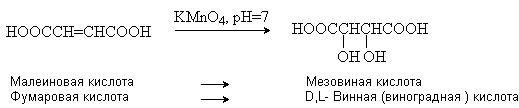
1.2. Химические
свойства.
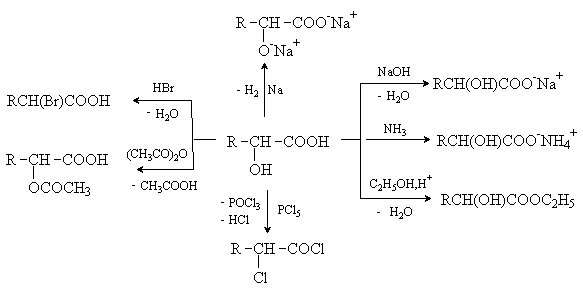
Гидроксикислоты дают реакции, характерные для карбоновых кислот и спиртов,
при этом могут затрагиваться как одна, так и обе функции. Наиболее характерные
реакции приведены на схеме.
Кроме того, гидроксикислоты имеют ряд
специфических свойств, обусловленных присутствием обеих групп и их взаимным
расположением.
Отношение гидроксикислот к
нагреванию.
Превращения гидроксикислот при нагревании
определяются возможностью образования термодинамически стабильных 5-ти-
6-тичленных циклов
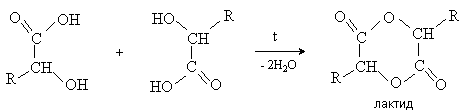
a -Гидроксикислоты
вступают в реакцию межмолекулярного самоацилирования. При этом образуются
циклические сложные эфиры –лактиды.
b -Гидроксикислоты при
нагревании переходят a ,b -непредельные кислоты.
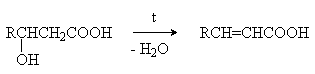
g — иd -Гидроксиокислоты претерпевают
внутримолекулярное ацилирование с образованием циклических сложных эфиров – лактонов.
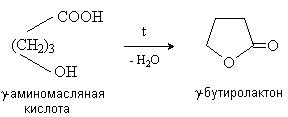
Специфические реакции a -гидроксикислот.
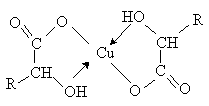
a -Гидроксикислоты
образуют хелатные комплексы с ионами переходных металлов (Cu2+ , Fe3+ и др.), которые содержат металл в
составе устойчивого 5-тичленного цикла.
В присутствии минеральных кислот a -гидроксикислоты разлагаются с
образованием муравьиной кислоты и соответствующего альдегида.
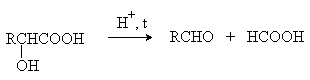
1.3. Биологически важные
гидроксикислоты.
Гликолиевая кислота HOCH2COOH содержится во многих растениях, например, свекле и
винограде.
Молочная кислота (соли лактаты) CH3CH(OH)COOH.
Широко распространена в природе, является продуктом
молочнокислого брожения углеводов. Содержит асимметрический атом углерода и
существует в виде двух энантиомеров. В природе встречаются оба энантиомера
молочной кислоты. При молочнокислом брожении образуется рацемическая
D,L-молочная кислота. D-молочная (мясо-молочная) кислота образуется при
восстановлении пировиногралной кислоты под действием кофермента НАД Н и накапливается в
мышцах при интенсивной работе.
| CH3COCOOH + НАД . Н + Н+ |
® |
СH3CH(OH)COOH + НАД+ |
| Пировиноградная кислота |
D-Молочная кислота |
Яблочная кислота (соли малаты) HOOCCH(OH)CH2COOH
Содержится
в незрелых яблоках, рябине, фруктовых соках. Является ключевым соединением в
цикле трикарбоновых кислот. В организме образуется путем гидратации фумаровой
кислоты и далее окисляется коферментом НАД+ до щавелевоуксусной кислоты.
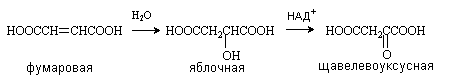
Лимонная кислота (соли цитраты)
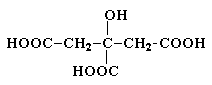
Содержится в плодах цитрусовых, винограде,
крыжовнике. Является ключевым соединением в цикле трикарбоновых кислот.
Образуется из щавелевоуксусной кислоты путем конденсации ее с ацетилкоферментом
А и далее в результате последовательных стадий дегидратации и гидратации
превращается в изолимонную кислоту.
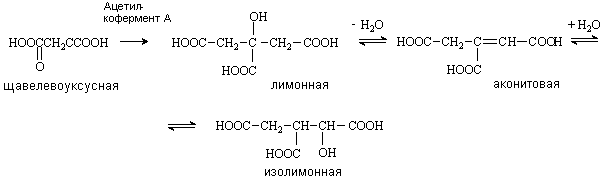
Винная кислота (соли тартраты) HOOCCH(OH)CH(OH)COOH.
Содержит два
хиральных центра и имеет 3 стереоизомера: D-винную кислоту, L-винную кислоту и
оптически неактивную мезовинную кислоту (см. лек. №4). D-винная кислота
содержится во многих растения, например, в винограде и рябине. При нагревании
D-винной кислоты образуется рацемическая D,L-винная (виноградная)
кислота. Мезовинная кислота образуется при кипячении других стереоизомеров в
присутствии щелочи и при окислении малеиновой кислоты (см. выше).
2. Оксокислоты
Оксокислоты – гетерофункциональные соединения,
содержащие карбоксильную и карбонильную (альдегидную или кетонную) группы. В
зависимости от взаимного расположения этих групп различают a -, b -, g — и т.д. оксокарбоновые
кислоты.
2.1. Методы
получения.
Для получения оксокислот применимы обычные методы введения карбоксильной и
оксогрупп. Специфический метод синтеза b -кетокислот – сложноэфирная конденсация. Методы
получения и биологические функции наиболее важных оксокислот приведены в таблице
10. .
Таблица 10. Методы получения и биологическая
роль оксокислот.
Оксокислота |
Методы получения |
Распространенность в природе и биологическая роль |
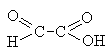 Глиоксиловая |
Окисление этиленгликоля:
|
Содержится в незрелых фруктах. Является промежуточным продуктом в ферментативном глиоксилатном цикле. |
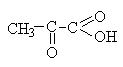 Пировиноградная (соли пируваты)
|
Окисление молочной кислоты:
Их ацетилхлорида и KCN с последующим
|
Центральное соединение в цикле трикарбоновых кислот. Промежуточный продукт при молочнокислом и спиртовом брожении углеводов. |
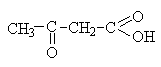 Ацетоуксусная |
Сложноэфирная конденсация:
|
Образуется в процессе метаболизма высших жирных кислот и как продукт окисления b -гидроксимасляной кислоты накапливается в организме больных диабетом. |
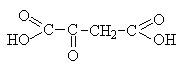 Щавелевоуксусная (соли оксалоацетаты)
|
Конденсация диэтилоксалата с этилацетатом:
|
Промежуточное соединение в цикле трикарбоновых кислот. Образуется при окислении яблочной кислоты и превращается далее в лимонную (см. выше). При переаминировании дает аспаргиноую кислоту (см. лек. №16) |
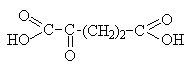 a -Кетоглутаровая |
Участвует в цикле трикарбоновых кислот и является предшественником важных аминокислот – глутаминовой и g -аминомасляной. |
2.2. Химические
свойства
Оксокислоты вступают в реакции, характерные для карбоксильной и карбонильной
групп. Отличительная черта оксокислот – легкость, с которой протекает их
декарбоксилирование.
a -Оксокислоты легко отщепляют СO2 и СО при нагревании в присутствии серной кислоты.
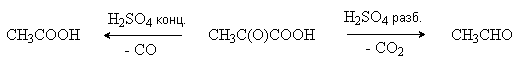
b -Оксокислоты
неустойчивы и самопроизвольно декарбоксилируются с образованием кетонов.
CH3COCH2COOH ® CH3COCH3 + CO2
b -Оксокислоты и их
эфиры обладают специфическими свойствами, которые связаны с их повышенной
СН-кислотностью. Повышенная подвижность протонов метиленовой группы обусловлена
электроноакцепторным влиянием двух карбонильных групп. В результате b -оксокислоты существуют в виде
двух таутомерных форм: кетонной и енольной (см. лек. №11), причем содержание
енольной формы в равновесной смеси значительное. Енольные формы дополнительно
стабилизируются за счет наличия в них системы сопряженных p -связей и внутримолекулярной
водородной связи.
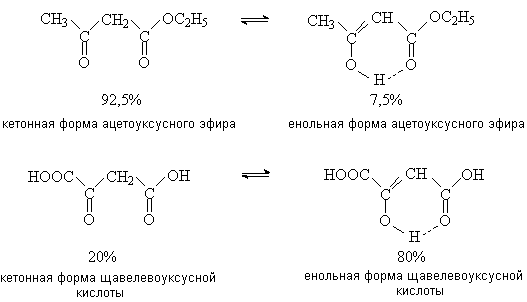
Центральное место среди b -оксокислот и их производных
занимает ацетоуксуный эфир (этиловый эфир ацетоуксусной кислоты). Существование
в виде двух таутомерных форм обуславливает его двойственную реакционную
способность. Как кетон, ацетоуксусный эфир присоединяет нуклеофильные реагенты:
HCN, NaHSO3, фенилгидразин. Как
енол, присоединяет бром, образует хелатные комплексы с ионами переходных
металлов, ацилируется хлорангидридами кислот.
При действии на ацетоуксусный эфир какого-либо
реагента в реакцию вступает один из таутомеров. Поскольку второй таутомер за
счет смешения равновесия восполняет убыль первого, таутомерная смесь реагирует в
данном направлении как единое целое.
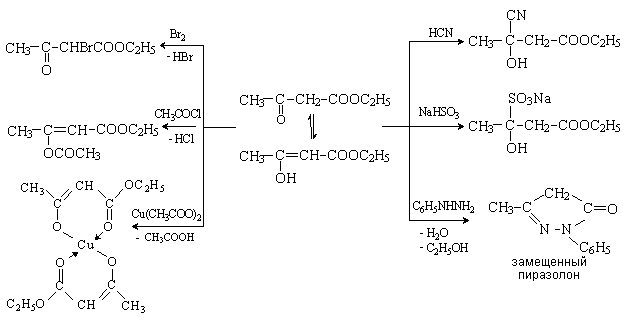
Ацетоуксусный эфир широко применяется в
органическом синтезе как исходное вещество для получения кетонов, карбоновых
кислот, гетерофункциональных соединений, в том числе производных гетероциклов,
представляющих интерес в качестве лекарственных средств. Так, производные
пиразолона используют как исходные вещества в синтезе ненаркотических
анальгетиков – антипирина, амидопирина и анальгина.
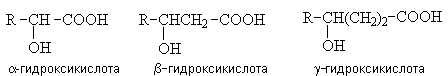
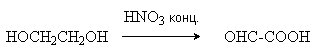
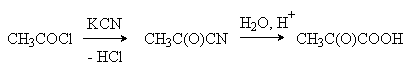
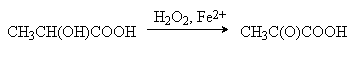
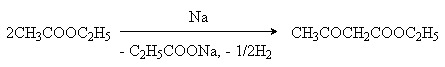
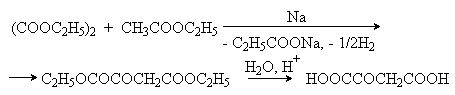
Почему не могу скачать лекцию