Лекция № 13. Амины
Лекция № 13
АМИНЫ
План
- Классификация.
- Методы получения.
- Химические свойства.
- Биологически активные амины и их
производные.
Лекция № 13
АМИНЫ
План
- Классификация.
- Методы получения.
- Химические свойства.
- Биологически активные амины и их
производные.
Амины можно
рассматривать как производные аммиака, в котором атомы водорода замещаются на
углеводородные радикалы.
1. Классификация
В зависимости от числа углеводородных радикалов, связанных с атомом азота,
различают первичные, вторичные и третичные амины, а также четвертичные
аммониевые соли.
| RNH2 | RR/NH | RR/R//N | RR/R// R///N+X— |
| первичныеамины | вторичные амины |
третичныеамины | четвертичные аммониевые соли |
По природе углеводородного радикала, связанного
с атомом азота, различают алкиламины, алкилариламины, ариламины,
гетероциклические амины.
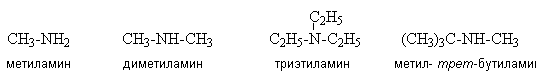
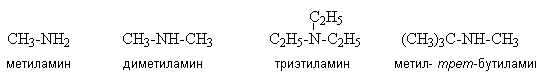
Алкиламины содержат только алифатические
углеводородные радикалы, например:
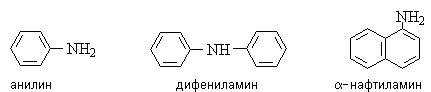
Ариламины содержат ароматические
радикалы с атомом азота в ароматическом кольце, например:
Алкилариламины содержат
алифатические и ароматические радикалы, например:
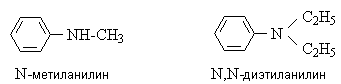
Гетероциклические амины содержат
атом азота в цикле, например:
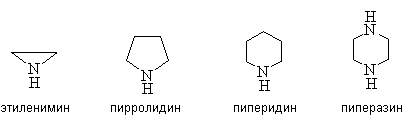
2. Методы получения.
- Алкилирование аммиака и аминов.
Аммиак взаимодействуют с алкилгалогенидами RX с образованием на
первой стадии соли алкиламмония, которая с избытком аммиака дает алкиламин.
Алкиламин, будучи более сильным нуклеофилом, чем аммиак, далее вступает в
реакцию алкилгалогенидом с образованием продукта диалкилирования. Таким
образом образуется смесь моно-, ди-, триалкиламинов и четвертичной
аммониевой соли.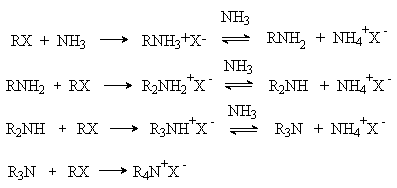
Спирты алкилируют аммиак и амины в
присутствии катализаторов дегидратации (Al2O3,
SiO2) при
300-5000C. В этом случае
также образуется смесь продуктов алкилирования.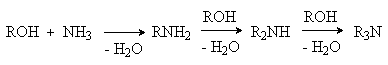
- Восстановление азотсодержащих
органических соединений.Нитросоединения могут быть
восстановлены до первичных аминов. Реакция используется в основном для
получения первичных ароматических аминов из доступных нитроаренов.ArNO2
 ArNH2
ArNH2 В качестве восстановителей используют
водород в присутствии катализаторов (Ni, Pt, Pd), металл (Fe, Zn, Sn) и
кислоту, соли металлов в низших степенях окисления (SnCl2,
TiCl3).Нитрилы при восстановлении
также дают первичные амины.RCN
 RCH2NH2
RCH2NH2 [H]: H2/Ni; LiAlH4
Амиды карбоновых кислот восстанавливаются до аминов комплексными гидридами металлов. Из
соотвествующих амидов могут быть получены первичные, вторичные и третичные
амины.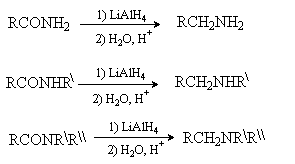
3) Восстановительное аминирование
альдегидов и кетонов (см. лек. №11).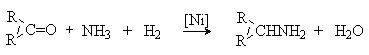
- Перегруппировка Гофмана.
RCONH2 + Br2 + 2NaOH ® RNH2 + 2NaBr + CO2 + H2OИспользуется для получения первичных
аминов.
3. Химические
свойства.
Химические свойства аминов определяются в основном присутствием атома азота с
неподеленной парой электронов, наличие которой обуславливает их основные и
нуклеофильные свойства.
Основные и кислотные свойства
Алифатические амины являются
сильными основаниями (![]() =10—11) и превосходят по основности аммиак. Их водные растворы имеют
=10—11) и превосходят по основности аммиак. Их водные растворы имеют
щелочную реакцию.
RNH2 + H2O = RNH3+ + OH —
Ароматические амины – слабые основания (![]() =3—5), что связано с разрушением
=3—5), что связано с разрушением
при протонированиии стабильной сопряженной системы, в которой участвует
неподеленная пара электронов азота (см. лек. №4).
При взаимодействии с кислотами амины образуют
растворимые в воде аммониевые соли.
RNH2 + HX ® RNH3+ X —
Первичные и вторичные амины являются слабыми N-H
кислотами (рКа=33-35) и образуют соли при взаимодействии с активными
металлами.
RNH2 + Na ® RNH— Na+ + 1/2 H2
Нуклеофильные свойства
Алкилирование аминов
Амины обладают нуклеофильными свойствами и алкилируются алкилгалогенидами и
спиртами (см. методы получения).
Ацилирование аминов
Амины ацилируются карбоновыми кислотами и их производными с образованием
амидов карбоновых кислот (см. лек. №12).
2RNH2 + R/COX ® R/CONHR + RNH3X
2R2NH + R/COX ® R/CONR2 + R2NH2X
(X=Cl, OCOR/)
Взаимодействие аминов с азотистой
кислотой
Первичные, вторичные и третичные амины по-разному взаимодействуют с азотистой
кислотой, что используется для установления типа амина. Неустойчивую азотистую
кислоту генерируют действием сильной кислоты на нитриты.
Третичные алифатические амины при обычной температуре с азотистой
кислотой не взаимодействуют.
Вторичные амины образуют с азотистой кислотой устойчивые нитрозамины – жидкие или твердые продукты желтого цвета.
R2NH + NaNO2 + HCl ® R2N-N=O + NaCl + H2O
являются сильными канцерогенами. Показана возможность синтеза нитрозаминов в
желудке человека из содержащихся в пище и лекарственных препаратах вторичных
аминов и нитритов Канцерогенное действие нитрозаминов основано на их способности
алкилировать нуклеофильные центры ДНК, что приводит к онкогенным мутациям.
Первичные алифатические амины реагируют с азотистой кислотой с
выделением газообразного азота. Реакция идет через образование неустойчивого
первичного нитрозамина, который изомеризуется в диазогидроксид, превращающийся
далее в соль диазония.
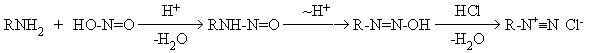
диазония
от природы углеводородного радикала.
Если R – алифатический радикал, то соль диазония очень неустойчива и
немедленно разлагается с образованием молекулы азота и карбокатиона, который
затем взаимодействует с находящимися в реакционной среде нуклеофилами (например,
с растворителем) или отщепляет протон и дает продукт элиминирования. Например,
превращения катиона н-пропилдиазония могут быть представлены следующей схемой:
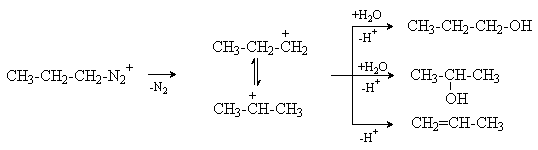
Реакция не имеет препаративного значения.
Процесс используется в аналитических целях для количественного определения
первичных алифатических аминов, в том числе природных a -аминокислот, по объему
выделяющегося азота.
Соли арилдиазония более устойчивы и могут
быть выделены из реакционной смеси. Они являются высокореакционноспособными
соединениями и широко используются в органическом синтезе.
Реакции солей арилдиазония
Процесс получения ароматических диазосоединений
называется диазотированием и выражается следующим суммарным
уравнением.
ArNH2 + NaNO2 + 2HCl ® ArN2+Cl— + NaCl + 2H2O
Реакции солей арилдиазония можно разделить на
два типа: реакции с выделением азота и реакции без выделения азота.
Реакции, протекающие с выделением азота. Этот тип реакций представляет собой замещение в ароматическом кольце, уходящей
группой в котором является молекула азота N2.
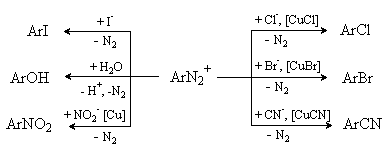
Реакции используются для введения различных
заместителей в ароматическое кольцо.
Реакции, протекающие без выделения азота. Наиболее важной реакцией этого типа является азосочетание. Катион
диазония обладает слабыми электрофильными свойствами и вступает в реакции
электрофильного замещения с аренами, содержащими сильные электронодонорные
заместители. При этом образуются азосоединения.
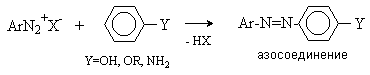
Азосоединения содержат длинную систему
сопряженных связей и поэтому окрашены. Они используются как красители.
Образование окрашенных соединений при взаимодействии солей арилдиазония с
ароматическими аминокислотами (тирозин, гистидин) используется для их
качественного и количественного определения.
Реакции ароматического кольца
ариламинов
Аминогруппа является сильным активирующим
заместителем и ориентантом II рода (см. лек. №8).
Анилин легко бромируется бромной водой с
образованием триброманилина.
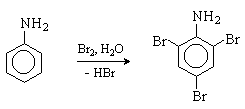
В большинстве реакций электрофильного
реакционноспособная аминогруппа предварительно защищается путем ацилирования.
После проведения реакции ацильную защиту снимают кислотным или щелочным
гидролизом.
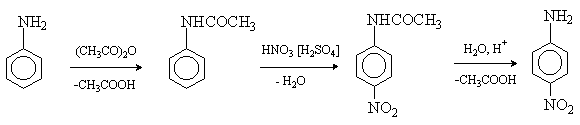
4. Биологически активные амины и их
производные.
Биологическую активность проявляют гетерофункциональные соединения,
содержащие аминогруппу – аминокарбоновые кислоты, аминоспирты, аминофенолы,
аминосульфокислоты.
Этаноламин и его производные.
Этаноламин (коламин)
HOCH2CH2NH2 является структурным компонентом сложных липидов (см. лек. №18). В организме
образуется при декарбоксилировании аминокислоты серина (см. лек. № 16).
Холин HOCH2CH2N+(CH3)2 – структурный компонент фосфолипидов; витаминоподобное
вещество, регулирующее жировой обмен; предшественник в биосинтезе
ацетилхолина.
Ацетилхолин CH3COOCH2CH2N+(CH3)2 — посредник при передаче нервных импульсов
(нейромедиатор). Накопление ацетилхолина в организме приводит к непрерывной
передаче нервных импульсов и сокращению мускульной ткани. На этом основано
действие нервнопаралитических ядов (зарин,табун), которые ингибируют действие
фермента ацетилхолинэстеразы, катализирующего расщепление ацетилхолина.
Катехоламины – дофамин,
норадреналин, адреналин – биогенные амины, продукты метаболизма аминокислоты
фенилаланина.
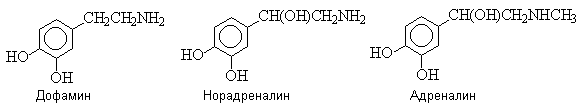
Катехоламины выполняют роль гормонов и
нейромедиаторов. Адреналин является гормоном мозгового слоя надпочечников,
норадреналин и дофамин – его предшественниками. Адреналин участвует в регуляции
сердечной деятельности, обмена углеводов. Увеличение концентрации катехоламинов
– типичная реакция на стресс. Их роль заключается в мобилизации организма на
осуществление активной мозговой и мышечной деятельности.
Структурно близки к катехоламинам некоторые
природные и синтетические биологически активные вещества, также содержащие
аминогруппу в b -положении к ароматическому кольцу.
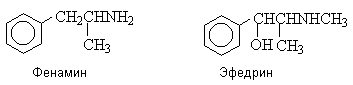
Фенамин является стимулятором центральной
нервной системы, снимает чувство усталости. Эфедрин – алкалоид, обладающий
сосудорасширяющим действием.
Производные п-аминофенола – парацетамол и фенацетин
– лекарственные препараты, обладающие обезболивающим и жаропонижающим
действием.
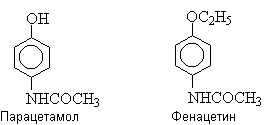
В настоящее время фенацетин рассматривается как
вещество, возможно являющееся канцерогеном для человека.
п-Аминобензойная кислота и ее
производные.
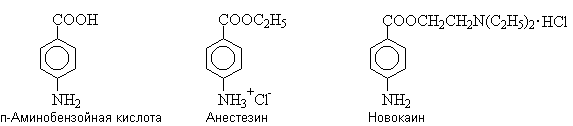
п-Аминобензойная кислота –
витаминоподобное вещество, фактор роста микроорганизмов; участвует в синтезе
фолиевой кислоты (витамина ВС). Сложные эфиры п-аминобензойной
кислоты вызывают местную анестезию.
Анестезин и новокаин применяются в виде растворимых в воде гидрохлоридов.
Сульфаниловая кислота (п-аминобензолсульфокислота) и
сульфаниламиды.
Амид сульфаниловой кислоты (стрептоцид ) и его N-замещенные производные –
эффективные антибактериальные средства. Синтезировано более 5000 производных
сульфаниламида. Наибольшую активность проявляют сульфониламиды, содержащие
гетероциклические основания.
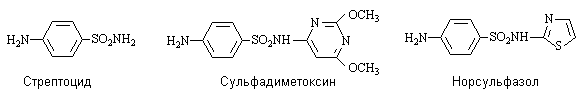
Антибактериальное действие сульфамидных
препаратов основано на том, что они имеют структурное сходство с
п-аминобензойной кислотой и являются ее атиметаболитами. Присутствующие в
бактериальной среде сульфаниламиды включаются в процесс биосинтеза фолиевой
кислоты, конкурируя с п-аминобензойной кислотой, и на определенной стадии
блокируют его, что ведет к гибели бактерий. Сульфаниламиды не влияют на организм
человека, в котором фолиевая кислота не синтезируется.