Лекция № 7. Ациклические непредельные углеводороды
Лекция № 7
АЦИКЛИЧЕСКИЕ НЕПРЕДЕЛЬНЫЕ
УГЛЕВОДОРОДЫ
План
- Алкены.
- Алкадиены.
- Алкины.
Лекция № 7
АЦИКЛИЧЕСКИЕ НЕПРЕДЕЛЬНЫЕ
УГЛЕВОДОРОДЫ
План
- Алкены.
- Алкадиены.
- Алкины.
1. А л к е н ы
Алкены – это углеводороды состава
СnH2n, содержащие в
молекуле одну связь С=С.
1.1. Методы получения
- Крекинг алканов
- Дегидрирование алканов
.gif)
- Дегидратация спиртов
.gif)
- Дегидрогалогенирование
галогеналканов
.gif)
- Дегалогенирование вицинальных
дигалогенидов
.gif)
1.2. Химические
свойства
Химические свойства алкенов определяются наличием связи С=С. p -Связь обладает меньшей
энергией, чем s -связи. Энергия двойной связи (611 кДж/моль) меньше удвоенной энергии простой
связи (703 кДж/моль). Связь С=С неполярна, но обладает большей поляризуемостью,
чем s -связи.
Поэтому она легко разрывается под действием электрофильных
(AdE реакции) и радикальных
(AdR реакции) реагентов. Кроме
того, p -связь
оказывает влияние на реакционную способность связи С-Н в аллильном положении,
что делает возможным протекание реакций радикального замещения атома
водорода.
Таким образом, молекулы алкенов содержат два
основных реакционных центра – связь С=С и связь С-Н в аллильном
положении:
.gif)
Основные типы реакций алкенов представлены на
схеме:
.gif)
1.2.1. Реакции электрофильного
присоединения
AdE реакции – основной тип
превращений алкенов. По электрофильному механизму к алкенам могут присоединяться
галогены, галогеноводороды, серная кислота, вода и другие электрофильные
реагенты.
Общий механизм реакции включает ряд
последовательных стадий:
.gif)
На первой стадии электрофил образует p -комплекс с
алкеном, в котором двойная связь выступает как донор, а электрофил как акцептор
электронов. Далее p -комплекс медленно перегруппировывается в карбокатион (s -комплекс). На последней
стадии происходит быстрое взаимодействие карбокатиона с нуклеофилом
(Y —) с образованием продукта
присоединения. Скорость-определяющей стадией процесса является стадия
образования s -комплекса. Ее скорость, а, следовательно, и скорость процесса в целом, зависит
от стабильности интермедиата – карбокатиона, который близок по энергии к
переходному состоянию лимитирующей стадии.
Относительная стабильность карбокатионов зависит
от возможности делокализации в них положительного заряда. Алкильные группы
обладают способностью понижать положительный заряд на соседнем атоме углерода за
счет +I-эффекта. Поэтому стабильность карбокатионов возрастает в ряду:
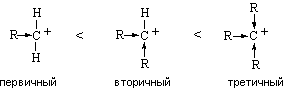
Таким образом, электронодонорные заместители
(алкильные группы) увеличивают реакционную способность алкенов, так как, с одной
стороны, повышают электронную плотность двойной связи, с другой стороны,
стабилизируют карбокатион. Электроноакцепторные заместители действуют в
противоположном направлении.
.gif)
Присоединение протонных кислот
Галогеноводороды и концентрированная серная кислота взаимодействуют с
алкенами с образованием соответственно алкилгалогенидов и алкилсульфатов:
.gif)
Реакционная способность кислот зависит от их
силы и возрастает в ряду: HF < HCl < HBr < HI
Механизм реакции:
.gif)
При присоединении кислот к несимметрично
замещенным алкенам возможно образование двух разных продуктов. Реакция протекает
региоселективно. Согласно правилу Марковникова, водород присоединяется к
наиболее гидрированному атому углерода:
R-CH=CH2 + HCl ® R-CHCl-CH3
Направление присоединения определяется
относительной стабильностью промежуточно образующихся карбокатионов:
.gif)
Реакция идет в направлении образования наиболее
стабильного вторичного карбокатиона, который образуется с большей скоростью.
Энергетическая диаграмма процессов образования первичного и вторичного
карбокатионов представлена на рисунке.
.gif)
Правило Марковникова не является универсальным.
Оно может нарушаться в случае изменения механизма реакции, а также при
присоединении кислот к алкенам, содержащим электроноакцепторные заместители,
обладающие –I-эффектом (CF3, +N(CH3)3 ) или –I-
и –М-эффектами (CHO, COOH, CN), например:
CF3CH=CH2 + HCl ® CF3CH2CH2Cl
В этом случае реакция также протекает в
направлении образования наименее дестабилизированного интермедиата, которым
является первичный карбокатион, так как в нем электроноакцепторный заместитель
не расположен в непосредственной близости от положительно заряженного атома
углерода:
.gif)
С учетом приведенных фактов можно сформулировать
следующее правило:
Электрофильное присоединение несимметричных
реагентов к несимметричным алкенам протекает в направлении образования наиболее
стабильного карбокатиона.
Это правило позволяет предсказать строение
продуктов присоединения к алкенам не только соединений типа HX, но и других
несимметричных реагентов (ICl, HOCl).
Гидратация алкенов
Алкены присоединяют воду в присутствии протонных
кислот в качестве катализаторов. При этом образуются спирты. Присоединение
происходит в соответствии с правилом Марковникова.
.gif)
Реакция протекает подобно присоединению кислот к
алкенам. Кислотный катализ необходим на стадии образования карбокатиона,
поскольку сама вода является слишком слабой кислотой и не создает достаточную
концентрацию ионов водорода. Затем вода как нуклеофил взаимодействует с
карбокатионом, образуя протонированную форму спирта. На последней стадии
процесса образуется спирт и регенерируется катализатор – кислота:
.gif)
Реакция используется для получения вторичных и
третичных спиртов.
Присоединение галогенов
Галогены легко присоединяются к алкенам с
образованием вицинальных дигалогенидов, например:
RCH=CH2 + Br2 ® RCHBrCH2Br
Реакционная способность галогенов возрастает в
ряду: I2 < Br2 < Cl2 <
F2. Присоединения брома используют как
качественную реакцию на двойную связь.
Механизм реакции:
.gif)
Реакция протекает через образование мостикового
бромониевого катиона, существование которого доказано спектральными методами.
Образование мостикового иона подтверждается также стереохимическим результатом
реакций галогенирования, которые протекают как транс-присоединение,
например:
.gif)
Присоединение карбокатионов к
алкенам
Карбокатионы, которые образуются при присоединении протона к алкенам,
являются электрофильными частицами и могут присоединяться к двойной связи другой
молекулы алкена, давая продукты алкилирования. Таким образом происходит
полимеризация алкенов под действием кислот:
.gif)
Реакции алкилирования являются способом
наращивания углеродной цепи и встречаются в процессах биосинтеза терпенов и
стероидов.
1.2.2. Реакции радикального
присоединения
p -Связь в алкенах может разрываться гомолитически под
действием радикальных реагентов. Наиболее важной реакцией этого типа является
реакция радикального присоединения HBr в присутствии перекисей (ROOR), которая
позволяет получать продукты “антимарковнинского” присоединения к несимметричным
алкенам:
![]()
Реакция протекает по цепному радикальному
механизму:
.gif)
Образуется продукт, которому предшествует более
стабильный свободный радикал. Реакция характерна только для HBr. В случае НСl и
HI радикальный процесс энергетически не выгоден.
1.2.3. Реакции окисления связи С =
С
Алкены легко окисляются. Состав продуктов
окисления зависит от окислителя и условий проведения реакции. Реакции окисления
можно рассматривать как электрофильное присоединение по связи С=С.
Эпоксидирование
Алкены взаимодействуют с надкислотами с
образованием эпоксидов:
.gif)
Эпоксиды обладают высокой реакционной
способностью и являются ценными продуктами в промышленном органическом синтезе.
Предполагают, что эпоксиды являются первичными продуктами ферментативного
окисления кислородом связей С=С, в том числе и в конденсированных ароматических
углеводородах.
Гидроксилирование
Алкены окисляются перманганатом калия в
нейтральной среде при комнатной температуре с образованием двухатомных
спиртов:
.gif)
Реакция используется как тест на присутствие в
соединении С=С связи.
Окисление KMnO4 в более жестких условиях (кислая среда, нагревание)
протекает с расщеплением углеродного скелета.
Озонолиз
Алкены взаимодействуют с озоном с образованием
озонидов, которые гидролизуются, давая карбонильные соединения и пероксид
водорода:
.gif)
Состав продуктов озонолиза позволяет установить
положение двойной связи в исходном алкене. Гидролиз озонида обычно проводят в
присутствии восстановителей (Zn), чтобы избежать окисления альдегидов пероксидом
водорода.
1.2.4. Реакции по аллильному
положению
Алкены, содержащие атом водорода в аллильном
положении, способны вступать реакции радикального замещения. Легкость протекания
таких реакций обусловлена высокой стабильностью образующегося при гомолитическом
разрыве связи С-Н в аллильном положении свободного радикала, так как в нем
возможна делокализация неспаренного электрона за счет сопряжения с соседней p -связью:
.gif)
Галогенирование
Хлорирование пропена хлором при высоких температурах дает продукт замещения,
а не присоединения:
![]()
Реакция протекает по радикальному
механизму:
.gif)
При использовании специальных бромирующих
реагентов и инициаторов радикальных реакций происходит бромирование алкенов по
аллильному положению:
.gif)
Окисление
Алкены взаимодействуют с кислородом по радикальному цепному механизму с
образованием гидропероксидов и продуктов их дальнейшего распада:
.gif)
По аналогичному механизму протекает пероксидное
окисление липидов in vivo с образованием моно- и дикарбоновых кислот.
2. А л к а д и е н ы
Алкадиены – это углеводороды состава
СnH2n-2, содержащие
две связи С=С. В зависимости от взаимного расположения двойных связей алкадиены
делят на три типа:
.gif)
Диены с изолированными связями по своим
свойствам мало отличаются от алкенов. Кумулированные и сопряженные диены
обладают рядом специфических свойств. Наибольший интерес представляют
сопряженные диены.
2.1. Методы получения сопряженных
диенов
Основной метод получения сопряженных диенов –
дегидрирование алканов и алкенов, выделяемых их нефти путем фракционной
перегонки:
.gif)
.gif)
2.2. Химические свойства сопряженных
диенов
Для сопряженных диенов известны все реакции, характерные для алкенов. Однако
их поведение отличает ряд особенностей.
В реакциях электрофильного присоединения сопряженные диены более активны, чем
алкены, так как реакции присоединения к ним электрофилов протекают через
образование термодинамически стабильных карбокатионов аллильного типа.
1,3-Бутадиен взаимодействует с бромом, давая смесь продуктов 1,2- и
1,4-присоединения:
.gif)
продуктов присоединения объясняет механизм реакции:
.gif)
карбокатион является резонансным гибридом, в котором положительный заряд
рассредоточен между атомами углерода в положениях 2 и 4, и поэтому содержит два
реакционных центра, по которым может присоединяться нуклеофил
(Br—). Соотношение продуктов
определяется температурой реакции. Продукт 1,4-присоединения термодинамически
более стабилен и преобладает при проведении реакции в условиях
термодинамического контроля (40оС). Продукт 1,2-присоединения
образуется с большей скоростью и преобладает при проведении реакции в условиях
кинетического контроля (-80оС). Энергетическая диаграмма процесса
бромирования бутадиена представлена на рисунке.
.gif)
Аналогично протекает присоединение
галогеноводородов к сопряженным диенам. При этом соблюдается правило
Марковникова:
.gif)
3. А л к и н ы
Алкины – углеводороды состава CnH2n-2, содержащие одну тройную связь углерод – углерод.
3.1. Методы получения
- Пиролиз алканов:
.gif)
- Гидролиз карбида кальция:
CaC2 + 2H2O ® C2H2 + Ca(OH)2 - Дегидрогалогенирование вицинальных и
геминальных дигалогенидов: - Синтез алкинов через магнийорганические
соединения:.gif)
Метод используется для получения гомологов
ацетилена.
.gif)
3.2. Химические
свойства
Химические свойства алкинов определяются
наличием связи Сє С, для которой характерны реакции присоединения электрофильных и нуклеофильных
реагентов. Кроме того, алкины с концевой тройной связью вступают в реакции
замещения водорода при тройной связи, который обладает слабыми кислотными
свойствами.
Таким образом, молекулы алкинов содержат два
основных реакционных центра – связь Сє С и подвижный водород:
![]()
3.2.1. Реакции присоединения по Сє С связи
В реакциях электрофильного присоединения алкины менее реакционноспособны, чем
алкены.
Присоединение галогенов
Ацетилен в присутствии катализатора FeCl3 присоединяет 2 моля хлора. Реакция протекает в две
стадии:
![]()
Присоединение галогеноводородов
Ацетилен присоединяет HCl только в присутствии катализаторов, содержащих соли
ртути(II):
.gif)
Присоединение второй молекулы HCl происходит без
катализатора, с соблюдением правила Марковникова:
CH2=CHCl + HCl ® CH3CHCl2
Замещенные ацетилены более реакционноспособны и
присоединяют галогеноводороды согласно правилу Марковникова:
![]()
Присоединение воды
В кислой среде в присутствии солей ртути(II) алкины взаимодействуют с водой с
образованием карбонильных соединений. На первой стадии алкины присоединяют воду
в соответствии с правилом Марковникова. Образующиеся при этом ненасыщенные
спирты (енолы) неустойчивы, и в условиях реакции быстро изомеризуются в
карбонильные соединения. При этом только в случае ацетилена образуется альдегид,
а его гомологи дают кетоны:
.gif)
3.2.2. Реакции с участием подвижного
водорода
Атом водорода, связанный с атомом углерода, находящемся в состоянии
sp-гибридизации, обладает кислотными свойствами и может отщепляться в виде
протона под действием сильных оснований:
.gif)
Равновесие реакции смещено в сторону более
слабой кислоты – аммиака
Алкены с концевой тройной связью реагируют с
солями тяжелых металлов, давая нерастворимые ацетилениды, например:
RCє CH + [Ag(NH3)2]OH ® RCє CAg Ї + 2 NH3 + H2O
RCє CH +
[Сu(NH3)2]Сl ® RCє CCu Ї + NH4Cl + NH3
Реакции используются как качественные на
концевую тройную связь.